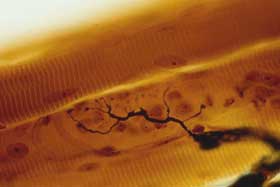
همه میکروبها زیانآور نیستند و حتی بسیاری از آنها به ما کمک میکنند.
پس میکروبهای بیماریزا چه هستند و چگونه به بدن آسیب میرسانند؟
میکروبهای بیماریزا، مانند همه موجودات زنده، برای رشد و تولیدمثل
به غذا احتیاج دارند. اما نمیتوانند مانند گیاهان سبز، غذای مورد نیاز
را خودشان بسازند. بنابراین باید غذای خود را به طور مستقیم یا غیرمستقیم
از دیگر موجوداتزنده به دست آورند. از این رو، میتوان فهمید که چرا
بیماری تولید میکنند. بیشتر میکروبهای بیماریزا انگلهستند؛ یعنی در بدن
جانداران دیگر به سرمیبرند و از آنها غذا به دست میآورند.
پس از آن که میکروبهای بیماریزا به جای مناسبی از بدن وارد شدند، به
سرعت رشد و تولیدمثل میکنند و اگر چیزی جلوی رشد و تولید مثل آنها را
نگیرد، از راههای گوناگون به بدن آسیب میرسانند. یکی از راهها این است که
مواد درون سلولهای بدن را به جای غذا مصرف میکنند. مانند انگلمالاریا
که در گلبولهایقرمز رشد و تولیدمثل میکند و آنها را از بین میبرد.
ویروسها نیز وارد سلولهای گوناگون بدن میشوند و با استفاده از مواد درون
آنها زیاد میشوند. ویروسها با این عمل، سلولها را از بین میبرند.
راه دیگری که میکروبهای بیماریزا به بدن آسیب میرسانند، ترشح سم یا “توکسین“ است. این سمها، از طریق جریانخون در سراسر بدن پخش میشود؛ مانند سم میکروبکزاز.
اشاره شد که اغلب میکروبهای بیماریزا، زندگی انگلی دارند و برای رشد و
تولیدمثل مجبورند در بدن دیگر جانداران زندگی کنند و از آنها غذا به دست
آورند، پس اگر این میکروبها وارد بدن انسان نشوند و کسی را بیمار نکنند،
در کجا زندگی میکنند؟
محل اولیهای که عامل بیماریزا در آن وجود دارد، “مخزن“ بیماری نامیده میشود.
بعضی از بیماریها مانند سرخک، آبله،حصبه و اوریون، ویژه انسان است؛
زیرا عامل بیماریزا خود را فقط با شرایط بدن انسان وفق داده است.
بنابراین، انسان تنها مخزن این بیماریها است. از اینرو، شرط ابتلا به هر
یک از این بیماریها این است که فرد سالم، یا با انسان آلوده تماس پیدا
کند یا در معرض تماس با مواد و یا وسائلی قرار گیرد که فرد بیمار آنها را
آلوده کرده است (مانند لباس، ملحفه و ظرف).
این بیماریها فقط مخزن انسانی دارند؛ ولی مخزن بعضی از بیماریهای
عفونی که انسان به آنها دچار میشود، جانوران مهرهدار هستند و عامل
بیماریزا از این جانوران به انسان سرایت میکند. پس این بیماریها مخزن
حیوانی دارند.
بیماریهای عفونی جانوران مهرهدار، که در شرایط طبیعی به انسان قابل انتقال هستند، "بیماریهایمشترکانسانوحیوان" یا "زئونوز" نامیدهمیشوند.
بیماریهای مشترک انسان و حیوان به چند صورت انتقال مییابند:
هنگامی که قسمتهائی از بدن یک جانور آلوده برای غذا مورد استفاده انسان قرار میگیرد؛ مانند دچار شدن به کرمکدو که از راه خوردن گوشت نیمه پخته گاو یا خوک آلوده ایجاد میشود.
گاهی حشرهای عامل بیماریزا را از طریق نیش زدن، از جانور مهرهدار
بیمار به انسان منتقل میکند. مانندکک که عامل انتقال میکروب طاعون از موش
به انسان است. به این حشرات “ناقل“ بیماری میگویند؛ زیرا سبب انتقال
بیماری میشوند. البته حشرات،
از راه دیگری هم باعث انتقال بیماریها میشوند. برای مثال، مگس از حشراتی
است که درون و بیرون بدنش اغلب آلوده به میکروب است و هنگامی که روی غذا یا
ظروف غذاخوری بنشیند مقداری از میکروبها را به آنها منتقل میکند. به این
نوع انتقال، انتقالمکانیکی میگویند.
اما همانطور که اشاره شد پشه، کک، شپش و کنه به طریق دیگر سبب انتقال
بیماری میشوند. این حشرات، بیماران را نیش میزنند و خون آنها را میمکند
و عامل بیماریزا را وارد بدن خود میکنند. بعد از آن وقتی که این حشرات
فرد سالمی را نیش میزنند تعدادی از این میکروبها را به بدن او وارد
میکنند.
ککها بیماری طاعون و نوعی بیماری “تیفوس“ را منتقل میکنند. مگسها هم
سبب انتشار بیماریهائی مانند فلجاطفال، حصبه و مسمومیتهایغذائی میشوند.
پس ناقل عامل بیماریزا موجود زندهای است که معمولا حشره یا بندپا است.
راه دیگر انتقال عامل بیماریزا، گازگرفتن است مانند بیماری “هاری“که
از راه گازگرفتن سگ یا گرگهار در انسان به وجود میآید. بیماری هاری هم
از بیماریهای مشترک انسان و حیوان است.
هنگامی که جانوران مهرهدار آلوده، عامل بیماریزا را از راه ادرار،
مدفوع یا شیر خود دفع میکنند، محیطزیست یا موادغذائی مورد استفاده
انسان آلوده میشود. مثلا“ گاو آلوده به “تب مالت“، از طریق شیر خود،
انسان را بیمار میکند.
مخزن بعضی از بیماریهای عفونی، طبیعت بیجان و بخصوص خاک است. پس این بیماریها "مخزن غیرزنده" دارند.
وقتی دوچرخهسواری میکنید، ممکن است به زمین بیفتید و زانویتان زخمی شود. بعضی از میکروبهای موجود در خاک، مثل میکروب بیماری کزاز، از راه پوست زخمی شده، وارد بدن میشوند.
بعضی از عوامل بیماریزا خود را با زندگی در خاک و محیط خارج تطبیق میدهند و بعضی از آنها برای مقاومت در شرایط نامناسب محیط به "اسپور" یا "هاگ" تبدیل میشوند. هاگ مدتها زنده میماند.
عامل بیماری کزاز، سیاه زخم و یک نوع مسمومیت غذائی به نام "بوتولیسم" از این طریق، مدتها در خاک زنده میماند.
| عنوان | پاسخ | بازدید | توسط |
| |
0 | 1177 | golfam |
| |
0 | 781 | golfam |
| |
0 | 760 | golfam |
| |
0 | 784 | golfam |
| |
0 | 671 | aniaz |
| |
0 | 785 | aniaz |
| |
0 | 755 | aniaz |
| |
0 | 657 | aniaz |
| |
0 | 1014 | aniaz |
| |
0 | 631 | anita |










.jpg)

























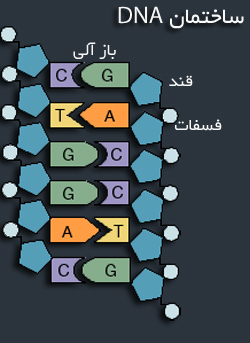
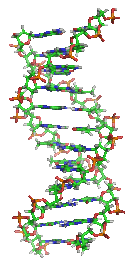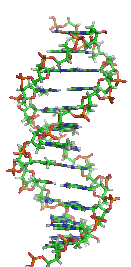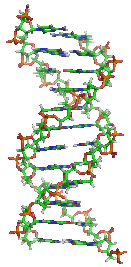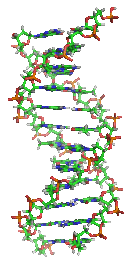 اسید دزوکسی ریبونوکلئیک (DNA) یک اسید نوکلئیک است که حاوی دستوران ژنتیکی مورد استفاده برای رشد و نمو و کارکرد همه جانداران است.
اسید دزوکسی ریبونوکلئیک (DNA) یک اسید نوکلئیک است که حاوی دستوران ژنتیکی مورد استفاده برای رشد و نمو و کارکرد همه جانداران است.






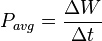
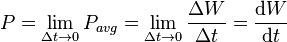


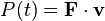

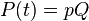
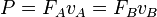




 توان لحظهای است به وات.
توان لحظهای است به وات.  اختلاف پتانسیل الکتریکی (یا تغییر ولتاژ) بین دو سر مولفه به ولت است.
اختلاف پتانسیل الکتریکی (یا تغییر ولتاژ) بین دو سر مولفه به ولت است.  جریان الکتریکی در آمپر است که از مولفه میگزرد.
جریان الکتریکی در آمپر است که از مولفه میگزرد.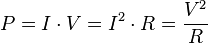
 مقاومت الکتریکی به اهم است.
مقاومت الکتریکی به اهم است.
 با دورهی
با دورهی  ، مانند زنجیرهای از پالس های یکریخت، توان لحظهای
، مانند زنجیرهای از پالس های یکریخت، توان لحظهای 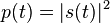 نیز تابعی متناوب با دوره
نیز تابعی متناوب با دوره ![P_0 = \max [p(t)]](http://upload.wikimedia.org/math/a/b/5/ab5143f0ee5b1e4c6c19d0479061dbb1.png) تعریف میشود. توان اوج همیشه به سادگی قابل اندازهگیری نیست، اما اندازهگیری توان متوسط معمول تر است. اگر انرژیِ هر پالس را به صورت زیر تعریف کنیم:
تعریف میشود. توان اوج همیشه به سادگی قابل اندازهگیری نیست، اما اندازهگیری توان متوسط معمول تر است. اگر انرژیِ هر پالس را به صورت زیر تعریف کنیم:

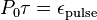 تا نسبت زیر برقرار باشد. به این نسبت چرخهی کار زنجیره پالس ها میگویند.
تا نسبت زیر برقرار باشد. به این نسبت چرخهی کار زنجیره پالس ها میگویند.

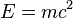 (باید توجه کرد که این معادله تنها انرژی موجود ذرات را بدست میدهد و نه دیگر گونههای انرژی (مانند جنبشی یا پتانسیل).
(باید توجه کرد که این معادله تنها انرژی موجود ذرات را بدست میدهد و نه دیگر گونههای انرژی (مانند جنبشی یا پتانسیل).
 در معادلات بالا یک انرژی جنبشی
در معادلات بالا یک انرژی جنبشی  است، اصطلاحی که بوسیله لرد کلوین در ۱۸۵۹ معرفی شد
است، اصطلاحی که بوسیله لرد کلوین در ۱۸۵۹ معرفی شد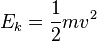
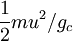 بیان میشود . بنابراین واحد انرژی جنبشی در این دستگاه عبارت خواهد بود از
بیان میشود . بنابراین واحد انرژی جنبشی در این دستگاه عبارت خواهد بود از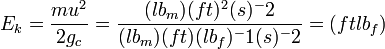
 ضروری است.
ضروری است.  به ارتفاع نهائی
به ارتفاع نهائی 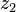 بالا رود، نیروئی حداقل معادل وزنش در جهت بالا باید بر آن اعمال شود
بالا رود، نیروئی حداقل معادل وزنش در جهت بالا باید بر آن اعمال شود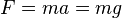
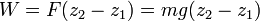 : معادله(۲)
: معادله(۲) ) است. بر عکس، چنانچه جسمی در برابر یک نیروی مقاوم معادل وزنش پایین آورده شود، کار انجام شده بوسیله جسم برابر تغییر در انرژی پتانسیل میباشد . معادله (۱) شکل مشابهی با معادله (۲) دارد و هر دو مبین این واقعیت هستند که کار انجام شده معادل تغییر در کمیتی است که شرایط جسم را در ارتباط با محیطش توصیف می نمایید . در هر دو حالت کار انجام شده را میتوان به وسیله معکوس نمودن فرایند و بازگرداندن جسم به شرایط اولیه اش بازیابی نمود .این مشاهده طبیعتاً به این تصور منتهی میشود که چنانچه کار اعمال شده بر روی جسم در شتاب دادن آن و یا در بالا بردن آن را بتوان بازیابی نمود، پس این جسم به وسیله خاصیتی چون سرعتش و یا ارتفاعش باید دارای استعداد و یا ظرفیت انجام این کار باشد این فرضیه در مکانیک جسم جامد آنچنان به خوبی ثابت شده است که ظرفیت یک جسم برای انجام کار نام انرژی به دادن اختصاص یافته است، نامی که از لغت یونانی اقتباس شده و به معنی انجام کار است و بنابراین کار شتاب دهده یک جسم باعث تغییر در انرژی جنبشی آن میشود
) است. بر عکس، چنانچه جسمی در برابر یک نیروی مقاوم معادل وزنش پایین آورده شود، کار انجام شده بوسیله جسم برابر تغییر در انرژی پتانسیل میباشد . معادله (۱) شکل مشابهی با معادله (۲) دارد و هر دو مبین این واقعیت هستند که کار انجام شده معادل تغییر در کمیتی است که شرایط جسم را در ارتباط با محیطش توصیف می نمایید . در هر دو حالت کار انجام شده را میتوان به وسیله معکوس نمودن فرایند و بازگرداندن جسم به شرایط اولیه اش بازیابی نمود .این مشاهده طبیعتاً به این تصور منتهی میشود که چنانچه کار اعمال شده بر روی جسم در شتاب دادن آن و یا در بالا بردن آن را بتوان بازیابی نمود، پس این جسم به وسیله خاصیتی چون سرعتش و یا ارتفاعش باید دارای استعداد و یا ظرفیت انجام این کار باشد این فرضیه در مکانیک جسم جامد آنچنان به خوبی ثابت شده است که ظرفیت یک جسم برای انجام کار نام انرژی به دادن اختصاص یافته است، نامی که از لغت یونانی اقتباس شده و به معنی انجام کار است و بنابراین کار شتاب دهده یک جسم باعث تغییر در انرژی جنبشی آن میشود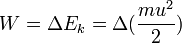
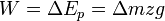
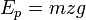

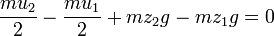
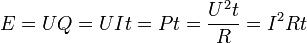

 دانلود رایگان گام به گام و حل تمرینات شیمی یازدهم
دانلود رایگان گام به گام و حل تمرینات شیمی یازدهم علایم کمبود ویتامین
علایم کمبود ویتامین